Villa Mafalda
Aree Contenuti
UTENTE
Strumenti e info
Gestisci da qui il tuo account e le prerogative come utente.
Rigenerazione delle cellule beta
30
Lug
2017
Una vera guarigione del diabete tipo 1 comporta il rinnovo delle cellule producenti insulina. Tecniche di riprogrammazione cellulare stanno avvicinandosi a questo decisivo risultato
"Con rammarico, devo iniziare la mia comunicazione dichiarando che non posso mostrare alcun risultato definitivo. Posso, al massimo, avanzare delle severe e isolate osservazioni, le quali suggeriscono che il pancreas ha una struttura più complicata di quanto si pensasse fino ad ora."
Paul Langherans, 1869
Paul Langherans, 1869
 Studiando il pancreas e preparando la sua tesi di laurea, il futuro fisiologo e patologo tedesco Paul Langherans si era chiesto se questâorgano nascondesse più segreti rispetto a quanto descritto fino a quel momento. Era stupito che allâopera esplorativa del grande fisiologo francese Claude Bernard, fondatore della medicina sperimentale, non avesse fatto seguito uno studio approfondito della struttura istologica della ghiandola. Questo suo stupore lo spinse avanti nei suoi studi di microscopia, portandolo allâidentificazione di aggregati cellulari con funzione misteriosa, ribattezzati isole di Langherans, dispersi tra gli altri sistemi di cellule con funzione esocrina.
Studiando il pancreas e preparando la sua tesi di laurea, il futuro fisiologo e patologo tedesco Paul Langherans si era chiesto se questâorgano nascondesse più segreti rispetto a quanto descritto fino a quel momento. Era stupito che allâopera esplorativa del grande fisiologo francese Claude Bernard, fondatore della medicina sperimentale, non avesse fatto seguito uno studio approfondito della struttura istologica della ghiandola. Questo suo stupore lo spinse avanti nei suoi studi di microscopia, portandolo allâidentificazione di aggregati cellulari con funzione misteriosa, ribattezzati isole di Langherans, dispersi tra gli altri sistemi di cellule con funzione esocrina. Dopo le fondamentali scoperte negli anni â20 del 1900, in cui venne delucidato da vari ricercatori che alla base del diabete tipo 1 stava la mancata produzione di un ormone, lâinsulina, da parte di questi gruppi di cellule specializzate pancreatiche, nel tempo è apparso sempre più chiaro come la perdita o la disfunzione delle cellule beta delle isole di Langherans del pancreas sia implicata in vario grado in tutte le forme di diabete.
Nel diabete tipo 1 le cellule beta vengono distrutte dallâattacco autoimmune dellâorganismo e si ha una virtuale scomparsa di cellule producenti insulina, con la necessità di una terapia sostitutiva totale. Nel diabete tipo 2 le cellule beta non riescono a produrre insulina sufficiente a vincere la resistenza insulinica delle cellule bersaglio, determinando un deficit insulinico relativo. Anche i meccanismi di altre forme di diabete, come il diabete gestazionale o le più rare forme genetiche, a trasmissione mendeliana in senso stretto, conducono in ultima analisi a unâinsufficiente o nulla produzione di insulina endogena.
Il lungo ritorno verso il cuore del problema
Le strategie terapeutiche messe in atto per la somministrazione di insulina, dallâiniezione sottocutanea, metodica nata 100 anni fa, ai sistemi di âpancreas bionicoâ recentemente approvati dagli enti di controllo, sono ancora un passo indietro rispetto a ciò che potrebbe essere considerato il vero Santo Graal della cura diabetologica: il ripristino o il rinnovo di cellule beta funzionanti, una promessa che sta impegnando da anni esperti di trapianto cellulare e specialisti in medicina rigenerativa.Un esempio degli sforzi fatti in tale direzione e di come questi possano rivelarsi insufficienti e frustranti è il trapianto eterologo di cellule beta. Nonostante gli apparenti successi iniziali, gli studi di follow-up hanno dimostrato come la maggior parte degli individui sottoposti a trapianto abbiano dovuto riprendere, entro 5 anni, la somministrazione di insulina esogena. Il prevedibile risultato è che lâinteresse verso questo filone di ricerca è comprensibilmente diminuito negli ultimissimi anni, sebbene chi ha investito molti anni di lavoro sul metodo non abbia intenzione di demordere facilmente.
La rigenerazione di cellule insulino-secernenti
Per risolvere i problemi incontrati con tecniche di trapianto di cellule già differenziate si è tentata la strada alternativa del trapianto di cellule beta ottenute dal differenziamento di cellule staminali, elementi che hanno il potere di dare origine a ogni tipo cellulare, con promettenti risultati. Le ultime ricerche si spingono però oltre: una strategia che appare ancora più audace e risolutiva è la rigenerazione di cellule beta secernenti insulina a partire da altri tipi cellulari presenti nel pancreas dello stesso paziente.A prescindere dallo specifico metodo messo in campo, appare evidente che lâattenzione dei ricercatori è tornata negli ultimi anni alla fonte del problema, per così dire. Nessuna terapia farmacologica ha avuto finora il potere di riportare le cellule produttrici di insulina verso la normalità : alcuni farmaci nel diabete tipo 2 tendono a âspingereâ il rilascio di insulina, a prezzo di una tendenza al deterioramento nel tempo della funzione insulino-secernente delle cellule beta (tipicamente sulfoniluree e glinidi), altri mimano lâazione insulinica a livello epatico riducendo lâoutput di glucosio (metformina) o migliorano la sensibilità insulinica periferica (glitazoni), altri ancora riproducono gli effetti di ormoni gastrointestinali ad azione ipoglicemizzante (agonisti GLP1 e gliptine) o by-passano lâazione insulinica riducendo la glicemia con altri meccanismi (gliflozine).
Nella terapia del diabete gli effetti ipoglicemizzanti dei farmaci percorrono quindi vie molteplici, ma nessun principio attivo ha potuto finora influenzare in modo decisivo la crescita dellâapparato insulino-secernente costituito dalle cellule beta del pancreas. Nel corso degli ultimi anni, per fortuna, le conoscenze nei meccanismi di regolazione dellâespressione genica e le tecniche di medicina rigenerativa sono cresciute enormemente, portando alla luce interruttori molecolari e vie biochimiche che possono diventare potenti strumenti in mano a ricercatori e clinici. Qualche anno fa i tentativi pionieristici di rigenerare il patrimonio di cellule beta insulino-secernenti furono effettuati in buona parte allâoscuro, in assenza del supporto di adeguate conoscenze. Ora stanno ripartendo su basi molto più solide, con risultati davvero incoraggianti.
Semplificare un progetto complesso
Reclutare cellule endocrine dal sistema esocrino del pancreas
Zhou e colleghi, in un lavoro pionieristico del 2008, hanno dimostrato come la semplice iniezione nel parenchima pancreatico di solo 3 geni, Neurog3, Mafa e Pdx1, possa indurre la differenziazione di cellule del pancreas in beta-cellule funzionali. Una volta aperta la pista di una tale possibilità , altri ricercatori si sono dedicati allâidentificazione di ulteriori meccanismi in grado di attivare la conversione cellulare, guidati dallâassunto che la natura tende a conservare e ottimizzare le soluzioni proposte dal processo di evoluzione: una stessa via biochimica, che rappresenta un modulo funzionale (in questo caso, il modulo di generazione di cellule beta) può essere attivata con interruttori diversi. Identificata una serratura si possono cercare le chiavi per aprirla, ma è anche possibile trovare una chiave alternativa o un passpartout. E in effetti, una ricerca pubblicata in gennaio 2017 sulla rivista Cells da Colombat e colleghi ha dimostrato come lâalterazione dellâespressione del gene Pax4 conduca alla trasformazione di cellule alfa, normalmente producenti glucagone, in cellule beta produttrici di insulina. Rifinendo i dettagli, lo stesso gruppo di ricercatori ha poi dimostrato che il gene Pax4 determina inizialmente la conversione di cellule dei dotti pancreatici - quindi di natura esocrina, non deputate alla secrezione di ormoni ma facenti parte del sistema di secrezione dei succhi digestivi pancreatici - in cellule alfa secernenti glucagone. Successivamente si ha la conversione di queste in cellule beta secernenti insulina, ultimo step che completa il processo.Un forte indizio che il processo si basi sullâattivazione di un preciso modulo funzionale di genesi beta-cellulare è riscontrabile nellâosservazione istologica del pancreas trattato, dove si sono formate nuove isole endocrine ben delineate morfologicamente, suggerendo che Pax4 induca la generazione di tali aggregati di cellule ricapitolando ciò che avviene durante il normale processo di differenziazione embrionale e fetale.
Nuovi paradigmi: accendere geni senza terapia genica
Un passo successivo, che può semplificare tecnicamente il processo di riprogrammazione cellulare e aprire più rapidamente la strada verso terapie concrete sul paziente, si affida ad avanzamenti recenti della biologia molecolare. Le difficoltà passate nel trapianto di geni terapeutici e nel controllo della loro espressione hanno rallentato per decenni i progressi reali in ambito clinico, ma sembrano adesso superabili dopo la scoperta che piccole molecole, somministrate come farmaco, possono mimare lâeffetto di specifici geni, "scavalcando" la necessità di lavorare direttamente, con tecniche più costose e difficili, sul gene che interessa. Farmaci che accendono nuove cellule beta
Un aiuto inaspettato da farmaci contro la malaria
Seguendo questo rivoluzionario paradigma, una nuova e incoraggiante ricerca ha dimostrato come alcune molecole possono mimare lo stesso effetto di riprogrammazione in senso beta ottenuto con lâalterazione dellâespressione del gene Pax4, seguendo una via più agevole. In particolare, si è scoperto che una classe di farmaci antimalarici conosciuti come artemisine hanno la capacita di inibire i livelli di ARX, una proteina che agisce come fattore di trascrizione, regolando lâattività di altri geni. Il gene ARX che la codifica fa parte della più vasta famiglia dei geni homeobox, i principali fattori di controllo dello sviluppo embrionale, in grado di presiedere come un direttore dâorchestra gli altri geni implicati nella morfogenesi delle strutture corporee. Nel pancreas, ARX appare come il regolatore epigenetico fondamentale della differenziazione delle cellule verso specifici tipi, in grado di garantire la flessibilità del sistema. Il blocco di questo attivatore attiva la trasformazione delle cellule alfa in cellule beta. Le artemisine causano una diminuzione del livello di ARX intracellulare e aumentano la secrezione di insulina in modelli cellulari di tipo alfa: questo misurabile effetto rappresenta la cartina di tornasole della loro spinta differenziativa in senso beta, provato anche dalla capacità di contrastare efficacemente lâiperglicemia in modelli di diabete del ratto. Il meccanismo di collegamento tra le artemisine e lâeffetto cellulare sembra basato sul recettore GABA, una proteina sulla membrana delle cellule che capta segnali dallâesterno e attiva un determinato comportamento intracellulare, in questo caso la diminuzione dei livelli di ARX.
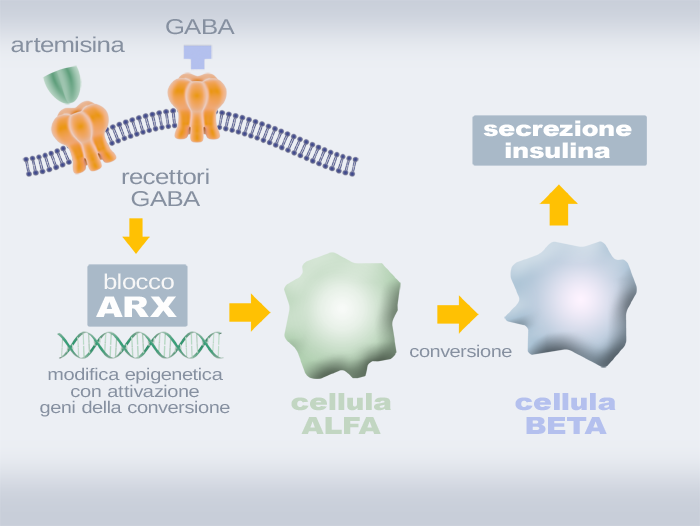
Fig. 1 - Conversione cellulare alfa-beta - Il farmaco antimalarico artemisina o il neurotrasmettitore GABA attivano i recettori GABA, i quali a livello intracellulare bloccano il fattore di trascrizione ARX, una chiave molecolare del processo di differenziazione delle cellule delle isole di Langherans. Si attivano di conseguenza meccanismi epigenetici di conversione delle cellule alfa in cellule beta secernenti insulina.
L'interruttore delle nuove beta-cellule
Questa nuova scoperta ha spostato lâattenzione sullâutilizzo del GABA (acido gamma-amino butirrico) in terapia: i ricercatori hanno ipotizzato che se il recettore del GABA è in grado di ridurre il livello di ARX, somministrare il suo attivatore naturale GABA per via sistemica potrebbe indurre lâevento di riprogrammazione delle cellule alfa, convertendole in cellule beta secernenti insulina. E in effetti, in topi trattati con GABA, si è visto che le dimensioni delle isole di Langherans crescono in proporzione alla durata della terapia, fino allo stupefacente risultato di un aumento di 3,5 volte dopo 3 mesi di terapia, senza evidenza di ipoglicemia. Inoltre, questo sviluppo delle isole risulta indipendente dallâetà , al contrario della capacità di crescita naturale che diminuisce nel tempo, sia nei topi sia in esseri umani. La prova del nove, per così dire, è stata effettuata in topi in cui si induceva il diabete tramite una tossina specifica per le cellule beta (streptozotocina). Anche in questo caso, dopo ogni dose di streptozotocina, la somministrazione di GABA correggeva lâiperglicemia e rigenerava le cellule beta, al contrario di ciò che accadeva negli animali di controllo, che sviluppavano forte diabete e a volte giungevano a morte per iperglicemia severa.
Gli studi sembrano quindi aver individuato un meccanismo fondamentale di mantenimento della capacità regolatrice della glicemia che agisce âalla sorgenteâ del problema, sul patrimonio di cellule beta funzionanti. Che si stimoli la via biochimica del recettore GABA tramite somministrazione di suoi agonisti o si percorrano strade più complicate come lâiniezione di geni, il risultato sembra davvero molto promettente ai fini della risoluzione del problema centrale dellâinsufficienza insulinica.
Una task force a caccia di nuove isole
La rigenerazione delle cellule beta producenti insulina tramite tecniche avanzate di riprogrammazione morfofunzionale può rappresentare la guarigione nel diabete tipo 1, dove abbiamo un deficit assoluto di insulina endogena, e contrasta uno dei due aspetti patogenetici principali del diabete tipo 2, il deficit insulinico relativo, essendo lâaltro costituito dallâinsulino-resistenza.
L'unione fa la forza: lo Human Islet Research Network
Nonostante le tante difficoltà di un progetto così ambizioso, la centralità di questo filone di ricerca è testimoniata dallâistituzione da parte dei National Institute of Health (NIH) statunitensi di una rete specifica di risorse, lo Human Islet Research Network (HIRN) dedicato alla ricerca sulle terapie basate sulla rigenerazione cellulare delle isole endocrine del pancreas. Per approfondire le conoscenze di base e accelerare il processo di medicina âtraslazionaleâ - lâapplicazione concreta in clinica dei portati della ricerca di base - il network si sta dedicando alla generazione di modelli âumanizzatiâ di cellule murine, ricreando nel topo la biologia del processo autoimmune alla base del diabete di tipo 1, allâidentificazione di biomarcatori delle diverse fasi biopatologiche della cellula beta (stress, morte, rigenerazione) che possano quantificare gli effetti delle terapie meglio dei soli aspetti morfologici. Inoltre, altre risorse sono dedicate in modo specifico alla ricerca di farmaci specifici che agiscono sui vari interruttori del processo di differenziazione cellulare. Lo scopo di questâapproccio multitask è quello di accorciare i tempi per la messa a punto di trial clinici che verifichino nel paziente lâefficacia dellâapplicazione terapeutica di tali importanti scoperte. La strada è ancora impervia ma le evidenze che giungono dal mondo della ricerca sarebbero state considerate fantascienza solo dieci anni fa.
FONTI BIBLIOGRAFICHE
2. Jin Li et al. Artemisinins Target GABA Receptor Signaling and Impair a Cell Identity. Cell, December 2016 DOI: 10.1016/j.cell.2016.11.010
3. Nouha Ben-Othman et al. Long-Term GABA Administration Induces Alpha Cell-Mediated Beta-like Cell Neogenesis. Cell, December 2016 DOI: 10.1016/j.cell.2016.11.002
6. BenOthman N, Vieira A, Courtney M, et al. Longterm GABA administration induces alpha cellmediated betalike cell neogenesis. Cell. 2017;168:73.e1185.e11.
RISORSE IMMAGINE
Fig. 1 - Conversione cellulare alfa-beta - Filippo Tomassetti - ArduaNet Graphics
FTEGDM





